Was ist Temperatur?
Hier geht es darum, was "Temperatur" bedeutet. Das hängt wiederum
eng mit der Definition des Temperatur-Begriffes zusammen. Eine
weitgehend davon unabhängige Frage ist, wie eine Temperatur-Skala
definiert wird, und wie bestimmte Größen von der Temperatur abhängen.
Hier werden bekannte Fakten dazu zusammengetragen. Es ergibt
sich daraus ein vereinfachender Vorschlag, wie Temperatur in der Schule
definiert werden sollte.
Es gibt verschiedene miteinander verträgliche Temperatur-Definitionen:
- Die thermodynamische Temperatur-Definition
- Die Temperatur-Definition der Statistischen
Mechanik
Dem Buch " Wärme und Bewegung - die Welt zwischen Ordnung und Chaos,
Heidelberg, Spektrum-der-Wiss.-Verlagsges., 1986,
(Spektrum-Bibliothek, Bd. 8) von P.W. Atkins folgend wird für eines
der einfachsten thermodynamischen Systeme (ein System, das nur zwei
Energiestufen einnehmen kann) die Definition der Temperatur und der
Entropie mit Hilfe von 2 Simulationsprogrammen
erläutert. Sie stehen - für die Bildschirmauflösung 1024 x 768 - zum
Herunterladen bereit.
Mehr hierzu finden Sie in jedem beliebigen Lehrbuch der
Statistischen Mechanik oder Thermodynamik.
Für die Schule ist zu überlegen, wie wesentliche Aspekte beider
Definitionen in vereinfachter Weise berücksichtigt werden, so dass Schüler
weder Fehlvorstellungen mitnehmen noch überfordert werden. Das wird
diskutiert in
1. Die thermodynamische Temperatur-Definition
Zugrundegelegt wird ein Carnotscher Kreisprozess. Das ist eine
idealisierte, ursprünglich auf einem idealen Gas als Arbeitsstoff
beruhende Wärmekraftmaschine, die reversibel und periodisch
zwischen zwei Wärmereservoirs mit unterschiedlichen Temperaturen arbeitet.
Man nennt einen Prozess reversibel (umkehrbar), wenn er ständig
Gleichgewichtszustände durchläuft. Es stellt sich heraus:
- Es gibt keinen Kreisprozess mit einem höheren Wirkungsgrad als dem
der Carnot-Maschine.
- Ihr Wirkungsgrad η ist unabhängig vom verwendeten Arbeitsstoff.
- Für den Wirkungsgrad η gilt: η = ( ΔQ1 +ΔQ2)/ΔQ1
= (T1-T2)/T1. Dabei ist ΔQ1
die bei der höheren Temperatur T1 aufgenommene Wärme, ΔQ2
(<0) die bei der tieferen Temperatur T2 "aufgenommene"
(d.h. - ΔQ2 > 0 ist die
tatsächlich bei T2 abgegebene Wärme). (ΔQ1
+ΔQ2 ist die nach außen abgegebene Arbeit.)
Mit etwas Algebra ergibt sich
ΔQ1/T1
= - ΔQ2/T2 bzw. T1/T2
= - ΔQ1/ΔQ2 . *)
Temperaturen lassen sich also mittels einer idealen Carnot-Maschine
vergleichen durch die Messung von Wärmemengen, also Energien. Nach Kelvin
kommt man damit auch zu einer Temperaturskala, indem man einen
Temperaturpunkt festlegt, z.B. den Tripelpunkt des Wassers mit T
= 273,16 K. Diese Temperaturskala ist identisch mit der
Temperaturskala aufgrund des idealen Gases.
Das ist eine konsistente Definition der Temperatur, da (nach Wikipedia
"Thermodynamische_Temperatur"):
1. zwei reversibel und periodisch arbeitende Carnot-Maschinen zwischen
den gleichen Reservoirs A und B genau den gleichen Wirkungsgrad haben,
auch unabhängig vom verwendeten Arbeitsstoff. D.h. bei gleichen
Paaren von Reservoirs liefert jede beliebige reversibel und periodisch
arbeitende Carnot-Maschine gemäß der Definition das gleiche
Temperaturverhältnis. Andernfalls könnte man nämlich die Carnot-Maschine
mit dem geringeren Wirkungsgrad "rückwärts" als Wärmepumpe betreiben, die
Maschine mit dem höheren Wirkungsgrad vorwärts, und zwar so, dass dem
Reservoir B gleich viel Wärme zugeführt wie entnommen wird. Dann hätte man
insgesamt eine periodisch arbeitende Maschine, die nur dem Reservoir A
Wärme entnimmt, daraus mechanische Arbeit gewinnt, jedoch Reservoir B
unverändert lässt. Das wäre ein Perpetuum Mobile 2. Art, das nach dem
zweiten Hauptsatz der Thermodynamik ausgeschlossen ist.
2. Betrachten wir drei Reservoirs A, B und C, jedes für sich im
thermischen Gleichgewicht. Obige Definition liefert dann drei
Temperaturquotienten T1/T2, T2/T3
und T1/T3. Damit die Temperaturdefinition
widerspruchsfrei ist, muss eine Konsistenzbedingung gelten: Lassen wir
eine erste Wärmekraftmaschine zwischen A und B und eine zweite
Wärmekraftmaschine zwischen B und C operieren. Die erste Maschine entnehme
dem Reservoir A eine Wärmemenge ΔQ1 und führe dem Reservoir B
die Abwärme ΔQ2 zu. Die zweite Maschine entnehme dem Reservoir
B genau die gleiche Wärmemenge ΔQ2 und führe dem Reservoir C
die Abwärme ΔQ3 zu. Insgesamt wird also dem Reservoir B gleich
viel Wärme zugeführt wie entnommen. Das System aus beiden Maschinen kann
damit als eine Wärmekraftmaschine zwischen A und C aufgefasst werden. Aus
den Gleichungen
ΔQ1/ΔQ2 = -T1/T2 und
(- ΔQ2)/ΔQ3 = -T2/T3
(die zweite Maschine nimmt - ΔQ2 auf)
folgt ganz analog einerseits physikalisch und andererseits auch als
Ergebnis einfacher Algebra die Konsistenzbedingung ΔQ1/ΔQ3
= -T1/T3.
Danach muss man bzgl. der Temperatur-Definition sagen:
(D1a) Nach der thermodynamischen
Temperatur-Definition ist Temperatur T derjenige Parameter, der die Aufnahme
und Abgabe von Wärme bei einer reversibel und periodisch
arbeitenden Maschine mit dem höchstmöglichen Wirkungsgrad (also einer
Carnot-Maschine) regelt. Reversibel heißt dabei: Die Aufnahme und
Abgabe von Wärme erfolgt jeweils im thermischen Gleichgewicht.
Für die Schule vereinfacht, aber damit vereinbar ist: "T ist ein
Parameter, der die Aufnahme und Abgabe von Wärme im thermischen
Gleichgewicht regelt". Das ist vage kompatibel mit "Temperatur
als Maß für den Wärmezustand". Bei zwei Systemen in Kontakt mit
unterschiedlichem "Wärmezustand" fließt Energie vom wärmeren zum kälteren.
Exkurs:
Nach *) wird die Entropie S definiert durch Entropieänderungen ΔS = ΔQ/T
. Dabei soll sich also bei der reversiblen Aufnahme der Wärmemenge
ΔQ bei der Temperatur T eine Entropieänderung ΔS ergeben. Bei einem
reversiblen Prozess lässt sich dann jedem Zustand (p,V,T, ...)
wegunabhängig eine Entropie S zuordnen (S ist eine Zustandsfunktion, die
ein totales Differenzial besitzt): Ganz gleich, welche Zustände reversibel
durchlaufen werden, gehört dann zu jedem Zustand (p,V,T, ...) eine
eindeutige Entropie S. Für einem reversiblen Kreisprozess ist die gesamte
Entropieänderung bei einem vollen Durchlauf 0, also ∫0 dQ/T = 0
(mit einem Umlaufsintegral über einen geschlossenen Weg im p-V-Diagramm).
(Aus dem Carnot-Prozess hatte sich ja ΔS1 = ΔQ1/T1
= - ΔQ2/T2 = - ΔS2 , also ΔS1
+ ΔS2 = 0 ergeben.) Wenn S so definiert
wird, wird bekanntes T vorausgesetzt, also z.B. definiert nach der
thermodynamischen Temperatur-Definition. T ist aber umgekehrt auch T = ΔQ
/ ΔS bzw. 1/T = ΔS / ΔQ. Man kann ahnen, dass damit Ableitungen
zusammenhängen könnten. So muss jede andere, damit gleichwertige
Definition die Beziehungen erfüllen:
|
1/T = (∂S(U,V)/∂U)V = konst oder auch T =
(∂U(S,V)/∂S)V = konst
|
mit partiellen Ableitungen. Die beiden Ausdrücke sind nicht einfach
Kehrwerte voneinander, sondern unterscheiden sich durch die verwendeten
grundlegenden Variablen (U und V bzw. S und V). Ähnlich sind
auch die Innere Energie U und die (Helmholtzsche) Freie Energie F, häufig
auch mit A abgekürzt, definiert durch F = U - T·S
Zustandsfunktionen, die ein totales Differenzial besitzen. Diese
Definition wird später noch erläutert werden.
Zu 2. Die Temperatur-Definition der
Statistischen Mechanik
Zum Download von 2
Simulationsprogrammen zur Untersuchung von Temperatur und Entropie,
basierend auf Vorschlägen von P.W. Atkins. Sie sind für die
Bildschirmauflösung 1024 x 768 vorgesehen.
Untersuchen Sie dazu mit Hilfe des PC-Programms ENTROPIE (nach
P.W. Atkins) zwei Systeme A und B, die in thermischem Kontakt miteinander
sind. A enthalte insgesamt Nmax_A Teilchen, B insgesamt Nmax_B Teilchen.
Es soll sich um 2-Niveau-Systeme handeln, d.h. jedes Teilchen kann in
einem von 2 Zuständen sein, im Grundzustand mit der Energie 0 und im
angeregten Zustand mit der Energie E. N_A Teilchen sollen die Energie E
haben, entsprechend N_B Teilchen.
Das könnte ein grobes Modell für ein Spin-System im äußeren Magnetfeld
sein, wo die Spins entweder parallel (Energie E) oder entgegengesetzt zum
Magnetfeld (Energie 0) ausgerichtet sind. Durch irgendwelche Prozesse, auf
die es thermodynamisch nicht ankommt, kann ein Teilchen seine
Anregungsenergie E verlieren und sie an irgendein anderes Teilchen in A
oder B übertragen. Die Teilchen selbst sollen ortsfest sein. Es gibt also
keine kinetische Energie in dem System. Insgesamt soll die
(Gesamt-)Energie U (Innere Energie = Summe aller Teilchenenergien)
konstant sein, sich aber über beide Systeme verteilen.
Gleichbedeutend damit wäre es, wenn ein angeregtes Teilchen aus dem Raum
A in den Raum B übertritt und stattdessen ein Teilchen im Grundzustand von
B nach A, wenn mit diesen Platzwechselvorgängen keine Energieänderung
(sondern nur ein Energietransport) verbunden ist.
Das Programm lässt zwei Analysemöglichkeiten zu:
- Eine "experimentelle Analyse", bei der das
Verhalten beider Teilsysteme simuliert wird.
- Eine "theoretische Analyse", bei
der für alle möglichen Verteilungen der angeregten Teilchen Kenngrößen
wie Temperatur, Entropie oder innere Energie berechnet und
dargestellt werden, ganz gleich wie die untersuchte Verteilung zustande
kommt.
2.1. Experimentelle Analyse der Fluktuationen:
2.1.1 In einer Versuchs-Variante 1 sollen anfangs N_A Teilchen in A
angeregt sein, keines in B.
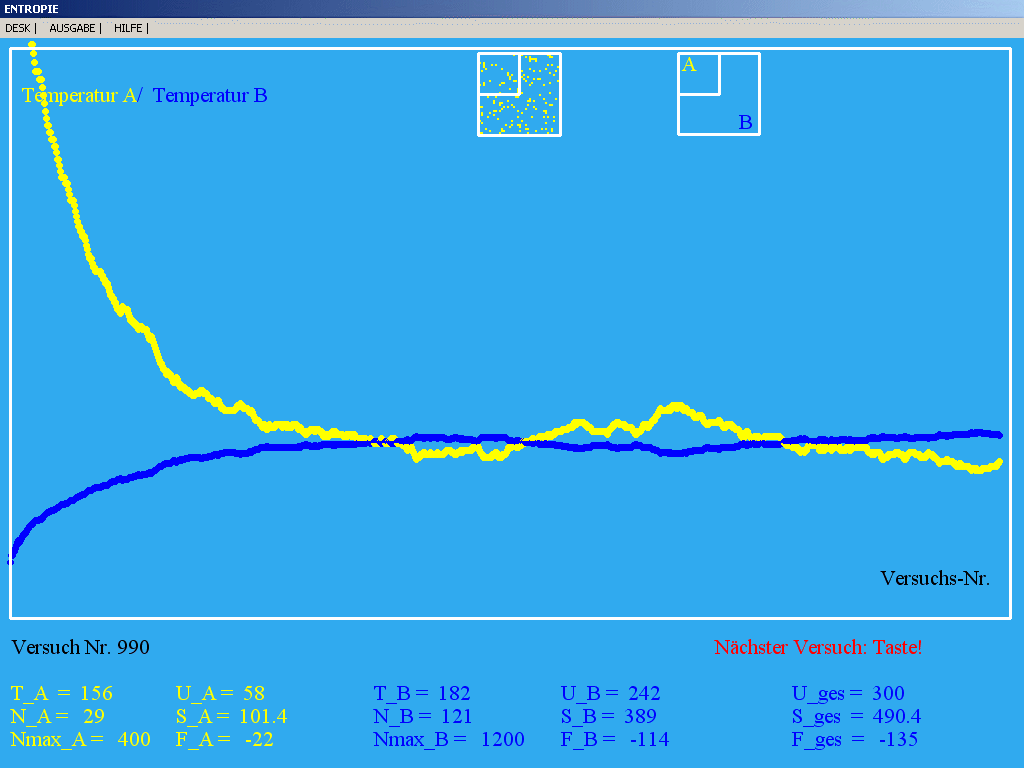 |
| Abb. 1: Experimentelle Analyse (Simulation)
des Zwei-Niveau-Systems in Räumen A und B im thermischen Kontakt
(Nmax_A = 400; Startwert N_A = 150; Nmax_B = 1200; Startwert N_B
= 0 ). Es werden jeweils Versuche durchgeführt, bei denen
die Energie von zufällig ausgewählten Teilchen verändert wird,
bis wieder insgesamt N_A + N_B = 150 Teilchen im
höherenergetischen Zustand sind.
Man erkennt die Fluktuationen der Temperaturen beider
Teilsysteme, das Streben gegen einen gemeinsamen
("dynamischen") Grenzwert, und das Entropie-Maximum (hier als
dynamischer Grenzwert der Entropie S mit zunehmender Zahl von
Versuchen) mit dem Wert 490,4 in willkürlichen Einheiten,
berechnet nach einer später zu besprechenden Methode. Weil
hier immer N_A < Nmax_A/2, ist die
Temperatur stets positiv (keine Besetzungszahl-Inversion).
|
In einem "Versuch" soll jetzt eine neue Verteilung der konstanten
Energie über die Zustände von A und B erfolgen. Die sich einstellenden
Zahlen der angeregten Teilchen in A und B (N_A und N_B) werden
registriert. Nach vielen Versuchen zeigt sich, dass sich Mittelwerte von
N_A und N_B herausbilden, um die die Teilchenzahlen schwanken, stärker
beim kleineren System A. Abgesehen von diesen Fluktuationen stellt sich
also nach und nach ein weitgehend stabiler Wert für die Verhältnisse
N_A/Nmax_A und N_B/Nmax_B ein. Beide Wert sind nach Einstellung des
"thermischen Gleichgewichts" gleich (das muss eine Bedeutung haben!). Die
Fluktuationen von Versuch zu Versuch werden im Quadrat oben mitte auch
visuell dargestellt, indem die angeregten Teilchen gelb markiert werden.
2.2. Experimentelle Analyse: Was kann man über die
Energieströmung zwischen zwei Systemen in thermischem Kontakt aussagen?
Die gesamte Energie eines Systems oder Teilsystems, die nicht
makroskopischer Art ist, heißt Innere Energie U. Auch nach
Einstellung des thermischen Gleichgewichts fluktuieren die Inneren Energie
U_A und U_B in beiden Systemen, obwohl insgesamt die Summe konstant ist.
Die dabei von einem System ans andere übertragene Energie heißt Wärme
Q. Wärme fließt dann einmal von A nach B, ein andermal von B nach A.
Im zeitlichen Mittel ist die Innere Energie nach Erreichen des thermischen
Gleichgewichts aber in beiden Teilsystemen konstant. Der für die
Wärmelehre wesentliche Anteil der Inneren Energie steckt in solchen fluktuierenden
Anregungen. Nur er wird hier betrachtet. Zu den Anregungszuständen
könnte auch, bei einem Gas etwa, die "ungeordnete Teilchenbewegung"
gehören.
Die Einstellung des thermischen Gleichgewichts ist mit einem
überwiegenden Energiefluss von A nach B verbunden, wenn anfangs in A
prozentual mehr angeregte Teilchen vorhanden waren als in B. ( Nmax -
N )/N ist das Verhältnis der Teilchenzahlen von nicht angeregten und
angeregten Teilchen eines Teilsystems. Wenn versuchsweise T's als
Funktionen der Teilchenzahlverhältnisse ( Nmax - N
)/N definiert werden:
| T1 = E/kB 1/ log [ ( Nmax_A -
N_A)/N_A ] mit der
Anregungsenergie E eines Teilchens und der Boltzmann-Konstanten kB,
und
T2 = E/kB 1/log [ ( Nmax_B -
N_B)/N_B ], allgemein
T = E/kB 1/ log [ ( Nmax -
N )/N ] ,
|
dann könnte anfangs T negativ sein, wenn nämlich mehr als
50% der Teilchen angeregt sind, wenn also N >= 1/2 Nmax. Das
soll jetzt nicht betrachtet werden. Ihm entspricht auch eine Situation,
die sich nur künstlich erreichen lässt (so genannte
"Besetzungszahl-Inversion"). Der Faktor E/kB sorgt dafür, dass
kBT die Dimension einer Energie hat. E dabei hat wesentliche
Bedeutung für die Interpretation von diesem T.
Ohne Besetzungszahl-Inversion ist mit dem anfänglichen N_B = 0
T2 = 0 und T1 > T2. Das bleibt
auch so bis zur Einstellung des thermischen Gleichgewichts. Dann gilt
offenbar bis auf Abweichungen durch Fluktuationen: T1 =
T2.
Folgerungen:
Jetzt folgt ein neuer Gedanke:
- Der absolute Temperaturnullpunkt (z.B. T2 = 0) ist dadurch
gekennzeichnet, dass kein Teilchen angeregt ist (das die höhere Energie
E besitzt), dass alle Teilchen im Grundzustand sind.
- Je höher T ist, desto höher ist der Bruchteil der Teilchen, die im
jeweiligen Teilsystem angeregt sind (die die höhere (Anregungs-)Energie
E haben). Für ihn gilt nach kurzer Rechnung wegen:
E / kBT = log( ( Nmax - N
)/N )
( Nmax - N )/N = exp ( E / kBT
)
Nmax /N - 1 = exp ( E / kBT
)
Nmax /N = 1 + exp ( E / kBT
)
also
| N / Nmax = 1/ ( 1 +
exp ( + E / kBT ) ) = exp (
- E / kBT ) / ( 1 + exp ( -
E / kBT ) ) |
Die Funktion f(x) = exp(-x)/(1+exp(-x)) = (1+exp(x))-1
ist eine monoton fallende Funktion. Für x => 0 (T =>∞ ¥
einem festen E >0) strebt f(x) => 1/2: ca. gleich viele
Teilchen sind dann im angeregten wie im Grundzustand. Für x =>
&in ( T => 0) verhält sich f(x) wie exp(-x) und geht
gegen 0: immer weniger Teilchen sind im angeregten Zustand.
- Die mittlere Energie eines Teilchens ist <E> = (
(Nmax - N)·0 + N·E ) / Nmax = N/Nmax
·E = E exp ( - E / kBT ) / ( 1 +
exp ( - E / kBT ) ) . Sie strebt gegen 0
für T => 0 und gegen E/2 für T => ∞. (Inwiefern ist also <E>
ein Maß für die Temperatur?) Im Nenner steht die so genannte Zustandssumme
Z aus "Boltzmann-Faktoren" exp( - Ei / kBT
) mit der Summe über alle möglichen Energiestufen Ei :
| Z = ∑i exp ( - Ei / kBT
) . |
- In allgemeineren Fällen kann man die mittlere Energie <E> mit
den Wahrscheinlichkeiten p(Ei) = exp ( - Ei / kBT
) / Z für die Besetzung eines Energieniveaus mit der Energie Ei
berechnen:
In Exponenten von p(Ei) = exp ( - Ei / kBT
) / Z werden sozusagen jeweils zwei Energien miteinander
verglichen: Die Anregungsenergie Ei und kBT. Je
größer kBT im Vergleich zu Ei ist, desto größer
ist die Wahrscheinlichkeit, dass Teilchen in das Niveau mit der
Energie Ei angeregt sind, grob: desto mehr Teilchen haben
die erhöhte Energie Ei (Ei sind die
Anregungsenergien gegenüber dem Grundzustand; vgl. Anhang
2). Hier also bewährt sich der Ansatz für T; formal müssen
natürlich auch die Argumente der Exponentialfunktionen dimensionslos
sein.
All dies passt recht gut zur Deutung von T1 und T2
als Temperaturen.
Damit könnten wir sagen:
(D1b) Die Temperatur T eines Systems ist ein
Parameter, der im thermischen Gleichgewicht bestimmt, wie die Energie
über die Energieniveaus der Mikrozustände (E1, E2,
E3, ... ) verteilt ist.
Für die Simulation des Programms wird vorausgesetzt, dass die beiden
Teilsysteme jeweils für sich im thermischen Gleichgewicht sind. Nur so hat
es einen Sinn, eine Temperatur zu definieren.
2.3. Experimentelle Analyse: Wodurch ist das thermische
Gleichgewicht bestimmt?
2.3.1 Dazu zuerst etwas Theorie: Die Teilchenzahl-Verhältnisse
N_A/Nmax_A und N_B/Nmax_B nähern sich offenbar mit zunehmender Zahl von
Versuchen bis auf Fluktuationen einem gemeinsamen Grenzwert ("dynamischer
Grenzwert"). Durch diese Gleichheit ist das thermische Gleichgewicht
bestimmt. Damit verbunden ist eine gemeinsame Temperatur T.
Offenbar gibt es i.A. für ein bestimmtes Teilchenzahl-Verhältnis sehr
viele Verteilungen der angeregten Teilchen über beide Teilsysteme. Im
Extremfall, wenn N_A = Nmax_A und N_B = 0 gibt es dagegen genau eine
Verteilung. Der Übergang von diesem Zustand zum thermischen Gleichgewicht
ist offenbar mit einer gewaltigen Vermehrung der möglichen Verteilungen
verbunden. Wenn umgekehrt N_A = 0 gibt es für das System im Raum A
ebenfalls genau eine Verteilung. Kann man diesen Übergang zum Maximum
genauer untersuchen? Dazu werden mit dem natürlichen Logarithmus log zwei
Funktionen S1 und S2 definiert:
| (1) S1(Nmax1,N_A) = kB
log g(Nmax1,N_A) und
(2) S2(Nmax2,N_B) = kB
log g(Nmax2,N_B) .
g(Nmax,N) = Nmax! / (Nmax
- N) ! N!
|
ist dabei die Anzahl der möglichen Verteilungen von N angeregten
Teilchen aus insgesamt Nmax Teilchen, wobei also Nmax
- N Teilchen im Grundzustand sind.
Das mathematische Symbol für "N aus Nmax" ist mit dem
Ergebnis identisch.
Jede dieser g(Nmax,N) Einstellmöglichkeiten wird ein
"Mikrozustand" genannt, der zu dem "Makrozustand" (Nmax,N
) beitragen kann.
Der Ausdruck für g((Nmax,N) ist leicht verständlich: Um
insgesamt Nmax Teilchen zu verteilen, gibt es Nmax!
Möglichkeiten. Dabei sind aber diejenigen äquivalent, bei denen nur die
angeregten Teilchen N untereinander und die nicht angeregten Teilchen
untereinander vertauscht werden. Deshalb muss durch die beiden Fakultäten
im Nenner dividiert werden.
Bei der Simulation wird durch g(Nmax,N) berechnet, auf
wie viele Weisen sich bei jedem Versuch das resultierende Wertepaar (Nmax,N
)
einstellen kann.
Es stellt sich heraus, dass die Funktionen S1 und S2
wachsen und fallen, aber dass S1 + S2 einem
Maximalwert zustrebt, wenn sich die beiden Systeme dem thermischen
Gleichgewicht nähern. Höchstens durch kurzzeitige Fluktuationen wird
dieser Maximalwert überschritten und wieder unterschritten, wenn er einmal
erreicht ist. Wechseln nämlich immer mehr Anregungen (nicht Teilchen) von
Teilsystem A in Teilsystem B, so vermehren sich zunächst die
Verteilungsmöglichkeiten in A und auch in B. Sind aber quasi alle
Anregungen aus A in B übergewechselt, gibt es in A wie in B immer weniger
Verteilungsmöglichkeiten (wir wissen: in A dann genau eine). Dazwischen
gibt es Bereiche, bei denen die Zahl der Verteilungsmöglichkeiten in A und
B unterschiedliche Tendenz haben. Zwischen den geschilderten Extrema gibt
es also eine Aufteilung, bei der die Zahl der erreichbaren
Verteilungsmöglichkeiten, charakterisiert durch S1 + S2,
maximal wird. Das geschieht beim thermischen Gleichgewicht. S1
+ S2 hat also eine physikalische Bedeutung und wird Entropie
genannt. Ebenso sind S1 und S2 Entropien der
Teilsysteme. Allgemein:
| S(Nmax,N) = kB log g(Nmax,N)
, wobei g die Anzahl der möglichen Mikrozustände
ist, die zu einem Makrozustand (Nmax,N) beitragen
können. |
Das thermische Gleichgewicht stellt sich ein, weil wegen des Maximums
der Zahl der möglichen Verteilungen (des Maximums der Entropie) "maximal
viele Wege dorthin führen". Das thermische Gleichgewicht ist durch die
wahrscheinlichste Aufteilung der angeregten Teilchen in Bereich
A und B gekennzeichnet.
Die Entropie S ist ein Maß für die Zahl der möglichen Verteilungen.
2.3.2 In der Versuchs-Variante 2 mit anfänglichem N_A = 0
des Versuchs beobachten Sie die Fluktuationen der Temperaturen und
Teilchenzahl-Verhältnisse in beiden Systemen nahe dem thermischen
Gleichgewicht (beim Entropie-Maximum). Die Fluktuationen sind
beträchtlich, aber geringer im größeren System. Man kann erwarten, dass
sie in sehr großen Systemen (Nmax in der Größenordnung der
Avogadrokonstanten) nicht mehr auffallen.
2. 4. In einer theoretischen Analyse
wird nicht mehr die Einstellung des thermischen Gleichgewichts
simuliert, sondern es werden für alle möglichen vorgegebenen Verteilungen
der angeregten Teilchen (wie auch immer diese zustandekommen) die
thermodynamischen Funktionen S, T, U und F mit den oben besprochenen
Definitionsformeln berechnet und dargestellt. Dabei kommen in realen
physikalischen Systemen negative Temperaturen i.A. nicht vor (nur
erreichbar bei "Besetzungszahl-Inversion"; rot markiert). Auch abnehmende
Werte der Gesamt-Entropie werden so gut wie nie beobachtet (rot markiert).
Sie erkennen:
- Die Entropie wird maximal gerade bei der wahrscheinlichsten
Verteilung (auch akustisch markiert durch Gong). Es gibt dann maximale
Anzahl von Möglichkeiten, die Aufteilung zu realisieren.
- Für die wahrscheinlichste Aufteilung sind die Temperaturen beider
Systeme wieder gleich.
- Die bei den gleichen Daten ermittelte Entropie des Maximums stimmt
mit der Gleichgewichts-Entropie der "experimentellen Analyse" überein,
die sich als "dynamischer Grenzwert" bei vielen Versuchen einstellt.
- Die Fluktuationen fallen prozentual umso weniger ins Gewicht, je
größer das System ist. Sehr große Systeme im thermischen Gleichgewicht
haben quasi konstantes Verhältnis der Zahl angeregter Teilchen zur
Gesamtzahl, quasi konstante Temperatur und quasi konstante Entropie. Als
Folgerung ergibt sich auch eine quasi konstante mittlere Energie
<E> eines Teilchens.
Das thermische Gleichgewicht entspricht also der wahrscheinlichsten
Aufteilung der Energie über beide Systeme bzw. dem Maximum der
Gesamt-Entropie.
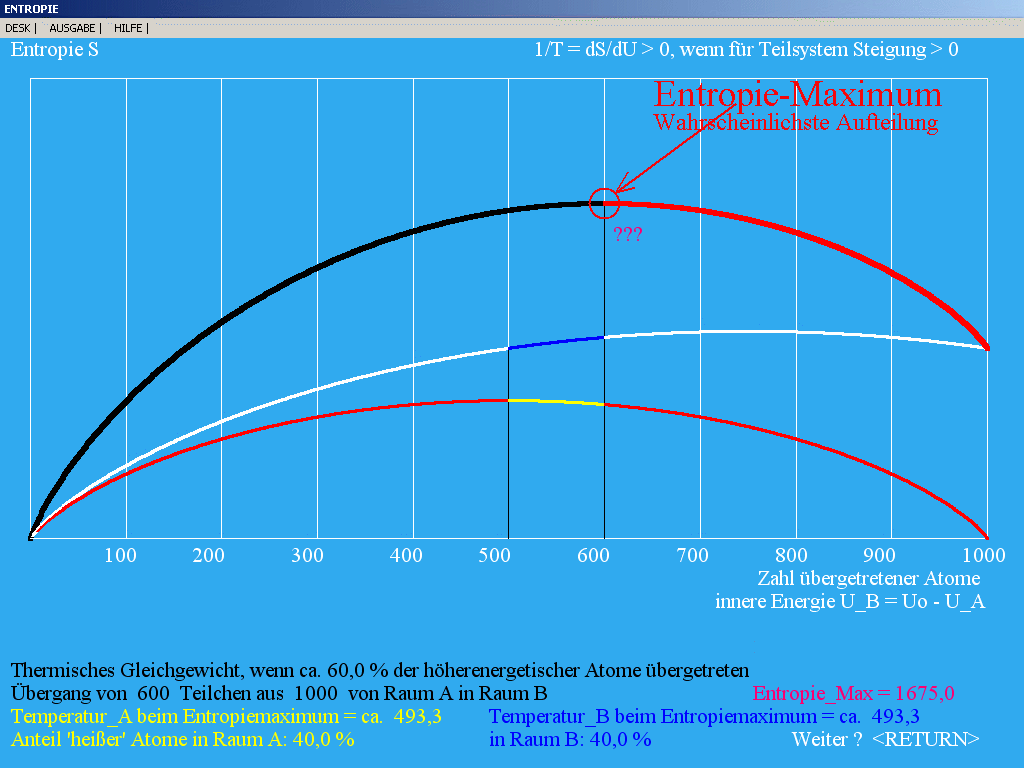 |
| Abb. 2: Theoretische Analyse des
Zwei-Niveau-Systems in Räumen A und B im thermischen Kontakt
(N_A = Nmax_A = 1000; Nmax_B = 1500 )
Die Entropiekurve 1 (unterste Kurve) von N_A = 0 bis N_A
= 500 ist rot gezeichnet, weil hier N_A >= Nmax_A (negative
Temperatur). Von N_A = 600 bis 1000 ist auch die
Gesamt-Entropie (oberste Kurve) rot markiert, weil diese
in diesem Bereich entgegen den Beobachtungen abnehmen müsste.
Mit den Daten von Abb. 1 würde sich der dort experimentell
ermittelte Gleichgewichtswert von S als maximale
Gesamt-Entropie hier bei ca. 121 übergetretenen Teilchen
ergeben.
|
Im Graphen sind die Entropien incl. der Gesamt-Entropie an Abhängigkeit
von N_B (bzw. der aus A übergetretenen Teilchen) dargestellt. Es bestätigt
sich:
- Beim thermischen Gleichgewicht ist die Entropie maximal.
- Beim thermischen Gleichgewicht sind die Temperaturen beider
Teilsysteme gleich.
- Beim thermischen Gleichgewicht haben beide Teilsysteme das gleiche
Verhältnis der Teilchenzahlen von angeregten und nicht angeregten
Teilchen.
| Beachten Sie:
All dies ist nur eine Folge der Statistik, also des
geschickten Zählens bzw. des "Gesetzes der großen Zahlen",
nicht von irgendwelchen "Mechanismen", die ein bestimmtes
Verhalten der Teilchen "bewirken" würden. Der
Gleichgewichtszustand ist der Zustand, zu dem die meisten Wege
führen, der sich auf maximale Anzahl von Weisen realisieren
lässt.
Über die Teilchen selbst wurden fast keine Annahmen
gemacht, außer dass sie in einem Grundzustand mit der Energie
0 und einem angeregten Zustand mit der Energie E vorkommen
können.
|
Die Steigung im Graphen ist proportional zur Ableitung von S_A nach N_B
(bzw. Nmax_A - N_A) und zur negativen Ableitung ∂S_A/∂U_A bzw. zur
Ableitung von S_B nach N_B und zur Ableitung ∂S_B/∂U_B. Beide
Ableitungen nach der Teilchenzahl sind beim Entropiemaximum
entgegengesetzt gleich; ihre Summe ist 0. Damit ist plausibel gemacht,
dass das thermische Gleichgewicht mit einem Extremum der
Gesamt-Entropie verbunden ist. Die Temperatur wird wie oben definiert und
für jede mögliche Verteilung berechnet, unter der Annahme, dass sich jedes
Teilsystem für sich im thermischen Gleichgewicht befindet. Im thermischen
Gleichgewicht, wenn also die Gesamt-Entropie maximal ist, sind die
Temperaturen beider Teilsysteme gleich, wie auch die Ableitungen ∂S_A/∂U_A
und ∂S_B/∂U_B.
Allgemein wird definiert: 1/T = (∂S(U,V)/∂U)V= konst
oder auch 1/T = (∂S(U,V)/∂U)Nmax = konst. Darin ist die
im Programm verwendete speziellere Definition für sehr große
Teilchenzahlen enthalten (Anhang). Also:
(D2a) Die Temperatur T misst, wie sich die Anzahl der
erreichbaren Zustände (in S enthalten) bei einer bestimmten Änderung der
Inneren Energie U verändert.
oder auch gemäß T =
(∂U(S,V)/∂S)V= konst.
(D2b) Die Temperatur T misst, wie sich die Innere Energie U
bei einer bestimmten Änderung der Anzahl der erreichbaren Zustände (in S
enthalten) verändert.
Auch die Freie Energie F = U - T·S nimmt im thermischen Gleichgewicht
einen konstanten Wert an.
Unabhängig davon, was der Begriff "Temperatur" bedeutet, ist die
Frage, wie eine Temperatur-Skala definiert wird. U.a. sind folgende
Definitionen der Temperaturskala in Gebrauch:
- die eben beschriebene thermodynamische Temperatur-Skala,
- die auf den Gesetzen des idealen Gases beruhende Skala, beruhend auf
p·V = N·kB·T bzw. p·V = n·R·T (mit Druck p,
Volumen V, Teilchenzahl N, Stoffmenge n (Anzahl der Mole des idealen
Gases), Boltzmannkonstante kB , allgemeiner
Gaskonstanten R und (absoluter) Temperatur T. Bei konstanten Druck gilt
dann T1/T2 = V1/V2
und man kann Temperaturen vergleichen über Volumenmessungen von
realen Gasen (z.B. He), die sich über weite Strecken wie ein ideales Gas
verhalten.
3. Temperatur in der Schule:
Es sind verschiedene Definitionen der Temperatur in der Schule in
Gebrauch (SD..: schulische Definition):
(SD1) Temperatur ist, was das Thermometer misst.
Darauf läuft es hinaus, wenn die Wärmelehre mit der Besprechung von
Thermometern begonnen wird. Das ist eine praktikable, aber auch für die
Schule etwas unbefriedigende Definition. Insbesondere ist für die Schüler
kein Anlass erkennbar, die Anzeige nicht - wie in der Umgangssprache -
"Wärme" zu nennen.
(SD2) Temperatur ist ein objektives Maß für den "Wärmezustand"
eines Systems.
Das ist der traditionelle Weg. "Wärmezustand" (Betonung auf Zustand;
eigentlich müsste es "thermischer Zustand" heißen) kann in der
Schule wohl nicht exakt definiert werden. Das ist aber auch verzichtbar.
"Wärmezustand" sollte aber in Zusammenhang gesetzt werden mit:
- "heiß - kalt"
- Je höher die Temperatur, desto mehr Teilchen sind in höhere
Energiezustände angeregt. (Bei Gas, Flüssigkeit, Kristall: desto mehr
Teilchen haben eine höhere kinetische Energie in der ungeordneten
Bewegung.)
- Je tiefer die Temperatur, desto weniger Teilchen haben eine höhere
Energie als die Grundzustandsenergie.
Wie gesagt: Dabei ist immer von der Gesamtenergie E der Teilchen die
Rede, die - je nach System - Photonenenergie (Hohlraumstrahlung),
kinetische Energie (ideales Gas), kinetische und potenzielle Energie
(reales Gas, Molekülgase), magnetische Energie (Spinsystem) etc. sein
kann.
- Je höher die Temperatur im Vergleich zu der eines zweiten Körpers in
thermischem Kontakt, desto mehr Energie fließt bei sonst gleichen
Bedingungen (also z.B. in gleicher Zeit) vom heißen zum kalten Körper.
Die folgenden Aspekte überfordern wohl die Schüler, wenn nicht Entropie
als Begriff explizit behandelt wird (man beachte: Entropie ist ein Maß für
die Zahl der erreichbaren Zustände):
- Je höher die Temperatur, desto weniger Entropieänderung ΔS tritt ein
bei derselben Wärmezufuhr ΔQ
- Je höher Temperatur, desto größere Wärmezufuhr ΔQ ist zur gleichen
Entropieänderung ΔS nötig.
Es genügt m.E. für die Schule, die ersten vier Punkte in den Raum
zu stellen. Insbesondere erscheint auch der Hinweis sehr nützlich, dass
bei höherer Temperatur mehr Teilchen eines Systems in höhere
Energiezustände (der Gesamtenergie) angeregt sein können.
Dabei ist es offenbar gleichgültig, um welche Energie es sich handelt.
Das könnte kinetische Energie sein wie bei einem idealen Gas, das ja keine
andere Energie haben kann. Das könnte die Summe aus kinetischer und
potentieller Energie sein wie bei einem realen einatomigen Gas oder bei
Molekülschwingungen eines zweiatomigen Gases, deren Mittelwerte bei
harmonischen Kräften gerade gleich groß sind und damit in gleicher Weise
von der Temperatur abhängen. Das könnte magnetische Energie sein wie im
einfachen System des Programms ENTROPIE, wo es keine kinetische Energie
und keine Teilchenbewegung gibt.
(SD3) Temperatur ist ein Parameter, der die Aufnahme und Abgabe von
Wärme im thermischen Gleichgewicht bei Kontakt zwischen zwei Systemen
regelt. Dies entspricht der thermodynamischen Definition der
Temperatur (D1a). Das Argument kann die Vorstellung von Temperatur
unterstützen; bleibt aber recht abstrakt.
(SD4) Die Temperatur T ist ein Parameter, der bestimmt, wie die
Energien von Teilchen im thermischen Gleichgewicht verteilt sind. Je
höher die Temperatur T, desto mehr Teilchen werden in höhere Energien
angeregt, oder in desto höhere Energien werden Teilchen angeregt, "desto
mehr Teilchen haben eine höhere Energie".
Diese Definition präzisiert (SD2) und entspricht im
Wesentlichen (D1b).
Etwas vager: "Temperatur T ist ein Maß dafür, "welche
(mikroskopischen) Energien im thermischen Gleichgewicht besetzt werden
können."
Ich würde an der Schule die
Definition (SD2) bevorzugen und sie später durch (SD4) ergänzen.
Warnungen:
1. Nicht als Temperatur-Definition verwendet werden sollte: "Temperatur
wird
definiert als Maß für die mittlere kinetische Energie eines Teilchens",
obwohl die Vorstellung sehr nützlich ist, dass bei höherer Temperatur
Teilchen in schnellerer ungeordneter Bewegung sind. Das entspricht ja den
Definitionen (D1b) und (SD4). Die Behauptung mit dem starken Bezug auf die
kinetische Energie ist überflüssig, da es nur geringfügig
schwieriger ist, gemäß (SD4) allgemeine Energien bei den angeregten
Zuständen ins Spiel zu bringen, wie es die Thermodynamik verlangt.
Statt zu sagen
"T ist ein Maß für mittlere kinetische Energie eines Teilchens
im thermischen Gleichgewicht. Je höher die Temperatur, desto höher ist die
mittlere kinetische Energie" (Aussagen, die für ein ideales Gas als
Aussage über die mittlere kinetische Energie eines Teilchens halbwegs
richtig sind),
kann man, nur geringfügig weniger griffig (dafür aber
verallgemeinerungsfähig und nicht ein Verständnis blockierend), die Definition
(SD4) verwenden.
Es gibt noch eine sprachliche Schwierigkeit bei der häufig in
Schulbüchern verwendeten Definition ("Temperatur als Maß für die mittlere
kinetische Energie der Teilchen"): Das klingt so, als sollte die
kinetische Energie aller Teilchen eines Systems betrachtet werden (also
ihre Summe) und davon sollte dann ein Mittelwert genommen werden. Genau
genommen ist dann nicht der Unterschied zur inneren Energie (als Summe der
Energien aller Teilchen) erkennbar, weil der Mittelwert nur eines Wertes
mit dem Wert übereinstimmt. Tatsächlich nimmt man den Mittelwert der
Energien jedes einzelnen der Teilchen, wie es eine Definition im Sinne von
"Temperatur als Maß für die mittlere Energie eines Teilchens des
Systems" verlangt.
2. Nicht hilfreich ist es, wenn man Innere Energie U und Temperatur T
gegeneinander abgrenzen möchte, sich auf eine Unterscheidung von Innerer (Gesamt-)Energie
U und mittlerer (kinetischer oder Gesamt-) Energie <E> als
Maß für T zu beschränken, da ja gilt: U = <E>·N (evtl. bis
auf thermisch irrelevante Anteile; i.A. <E> mittlere Gesamtenergie eines
Teilchens des Systems), wenn die Teilchenzahl N konstant ist, wie
das in den schulischen Beispielen häufig der Fall ist. Bei fester
Teilchenzahl N sind U und <E> proportional zueinander und hängen,
auch beim idealen einatomigen Gas, in der gleichen Weise von T
ab. Wenn es nur ideale Gase gäbe, wären beide ein Maß für die mittlere
Energie eines Teilchens, U auch noch für die Teilchenzahl. Es ist dann
kaum einzusehen, dass man zwei verschiedene Begriffe U und T für "das fast
Gleiche" benötigt.
Die Wesensverschiedenheit beider Begriffe bemerkt man erst, wenn man
Systeme mit unterschiedlichen Teilchenzahlen, aber gleicher Temperatur
oder aber gleicher Innerer Energie, vergleicht. Dann wird auch evident,
dass U eine extensive Größe ist, die von der Teilchenzahl
abhängt, T aber eine intensive, die unabhängig von der
Teilchenzahl ist. Mit dieser wesentlichen Aussage verträglich ist es, dass
U die gesamte Energie (egal ob kinetische oder potenzielle oder gar eine
ganz andere) des Systems misst, und T ein Parameter ist, der den
"Wärmezustand" jedes beliebigen Teils des Systems misst, wenn dieser mit
dem Rest im thermischen Gleichgewicht ist. Mit zwei "Modellgasen" mit 3
bzw. 5 Teilchen gleicher mittlerer Energie habe ich das durch einfache
Kopfrechnungen meinen Schülern klar gemacht. Man verwende dazu einfache,
wenn auch unrealistische Zahlenwerte (z.B. "Gas 1" mit 3 Atomen von
1 J, 3 J und 5 J, "Gas 2" mit 5 Atomen von 1 J, 2 J, 3 J, 4 J und 5 J,
jeweils der Gesamtenergie).
3. Die Betonung des Wortteils "kinetischer" Energie im
Unterschied zu (mittlerer) potenzieller Energie ist zudem verfehlt, da ein
ideales einatomiges Gas ja nur kinetische Energie besitzt. Von einer
Betrachtung des idealen Gases her kann man überhaupt keine Aussage machen,
wie sich eine mittlere potenzielle Energie verhalten würde. Darüber macht
in anderen Fällen der "Virialsatz" Aussagen. Wie auch die
Überlegungen zum Programm ENTROPIE zeigen, geht es in der Statistischen
Mechanik um die Gesamtenergie E der Einteilchen-Zustände.
4. Vielfach wird aus einem missverstanden Verhalten der mittleren
kinetischen Energie fälschlich auf das Verhalten der Temperatur
geschlossen. Dabei wird nicht beachtet,
- dass dort, wo ein System kinetische und potenzielle Energie besitzt,
beide im thermischen Mittel häufig gleiche Temperaturabhängigkeit
aufweisen,
- dass in die Quantentheorie (die ja eigentlich der Statistischen
Mechanik zugrundeliegt) ohnehin nur Eigenzustände der Gesamtenergie
eingehen,
- dass bei harmonischen Kräften die Mittelwerte von Ekin und
Epot sogar exakt gleich sind (wie der Virialsatz behauptet)
und damit mit Sicherheit die gleiche Temperaturabhängigkeit besitzen.
5. Vielfach wird auch fälschlich die Konstanz der Temperatur beim
Sieden oder Schmelzen dadurch erklärt, dass während des Schmelzens
oder Siedens durch Energiezufuhr nur die mittlere potenzielle Energie
gesteigert werde, die mittlere kinetische Energie hingegen konstant
bleibe. Wie Sie wissen, kann man in dynamischen Systemen potenzielle
Energie nur steigern (bis zur Ablösung eines Teilchens), indem man
gleichzeitig die kinetische Energie erhöht! Wesentlich ist, dass bei
solchen Phasenübergängen die schnellsten Teilchen (mit der höchsten
Energie) aus der einen Phase (Teilsystem A) in die andere (Teilsystem B)
abwandern. Die um die Bindungsenergie geänderte (konstante)
Grundzustandsenergie für die zweite Phase hat keinen Einfluss auf die
Besetzungszahl-Verhältnisse bzw. die mittlere Energie eines Teilchens der
Phase A. Beide Teilsysteme müssen auch gleiche Temperatur haben, weil sie
in thermischem Kontakt miteinander stehen.
6. Zudem gibt es viele wichtige Systeme, die gar keine kinetische
Energie, aber doch eine Temperatur besitzen, wie zum Beispiel die
Hohlraumstrahlung oder die kosmische Hintergrundstrahlung oder ein
Spinsystem. Würde man die Temperatur "als Maß für die mittlere kinetische
Energie eines Teilchens" definieren, wäre unverständlich, dass Strahlung
eine Temperatur haben kann. So wird üblicherweise das
Stefan-Boltzmann-Gesetz aus der Inneren Energie eines Photonengases und
seiner Temperatur hergeleitet. Früher, bevor man erkannte, dass
Strahlung ein eigenes thermodynamisches System mit einer eigenen
Temperatur sein kann, behalf man sich mit der Hilfsvorstellung, dass die
im Strahlungsgesetz vorkommende Temperatur die Temperatur der
Hohlraumwände sei, die ja im Idealfall wirklich mit der Strahlung im
thermischen Gleichgewicht stehen und also die gleiche Temperatur wie diese
haben.
7. Zur Frage, welche Temperatur ein Vakuum hat, lautet die
Standard-Antwort, dass es keine habe, da es keine Materie enthalte, die
mit einer kinetischen Energie verbunden sei. Selbstverständlich ist, dass
ein "System" vorhanden sein muss, dessen thermisches Verhalten man durch
eine Temperatur beschreiben könnte. Gäbe es ein absolutes Vakuum, so würde
dieses System fehlen. Gäbe es aber einen absolut materiefreien Raum, so
enthielte dieser durchaus noch Strahlung. Wenn diese im thermischen
Gleichgewicht ist, besitzt sie eine Temperatur. So ist der
intergalaktische Raum - das beste existierende "Vakuum" - weder ganz
materiefrei (typisch 1 Atom pro cm3) noch frei von der
kosmischen Hintergrundstrahlung, die sehr wohl eine Temperatur hat.
Mit dem Programm ENTROPIE wird stattdessen die übliche korrektere
und allgemeinere Auffassung von T veranschaulicht.
Die Lehrplanformulierung "absolute Temperatur als Maß für die
mittlere kinetische Energie eines Teilchens" ist korrekt zu lesen
als: "Die mittlere kinetische Energie eines Teilchens ist proportional
zur absoluten Temperatur". Sie macht eine Aussage über die mittlere
kinetische Energie eines Teilchens. Sie wird falsch interpretiert, wenn
sie als Definition oder Begriffserklärung der absoluten Temperatur
aufgefasst wird.
**) Korrekt müsste der Satz umgekehrt werden: "Die mittlere
(kinetische) Energie eines Teilchens (wie auch die innere Energie U des
Gases) im thermischen Gleichgewicht ist proportional zu T. Je höher die
Temperatur, desto höher ist die mittlere (kinetische) Energie".
Der Satz macht eine Aussage über die mittlere (kinetische) Energie und
nicht über die Temperatur. Wenn es nur ideale Gase gäbe, könnte man
darauf eine Temperaturdefinition aufbauen bzw. ihn, wie oben zitiert,
als Aussage über die Temperatur lesen. Aber auch an der Schule spielen
andere Systeme (reale Gase, Strahlung) eine wichtige Rolle. In jedem
Fall aber erlaubt der zugrunde liegende Sachverhalt die Definition einer
Temperatur-Skala, die in weiten Grenzen praktisch durchführbar ist, weil
es Gase gibt, die sich weitgehend wie ein ideales Gas verhalten.
II Entropie
Mit dem Programm 2KAMMGAS ("Zweikammer-Gas") wird die
(reversible) Diffusion eines Gases aus einem Volumen A durch eine Öffnung
in ein Volumen B untersucht. Die Meinung ist die, dass zunächst alle
N Teilchen in dem einen Volumen A enthalten sind. Sobald ein
zufällig ausgewähltes Teilchen auf die Öffnung trifft, wechselt es in den
jeweils anderen Bereich über. Nach kurzer Zeit finden Wechsel von A nach B
wie von B nach A statt. Der Platzwechsel ist nicht mit einer
Energieänderung verbunden. (Im betrachteten Ein-Niveau-System hat es
keinen Sinn, eine Temperatur zu definieren, weil T ja eine Aussage macht,
wie angeregte Energie-Zustände das System besetzt werden.) Es gibt zwei
Darstellungsmodi:
a) von jedem Teilchen (unterschieden durch unterschiedliche Orte) wird
gekennzeichnet, in welchem Raum es sich befindet.
b) Die Teilchen in Raum A und die in Raum B werden gruppiert, wie in der
Abbildung 3.
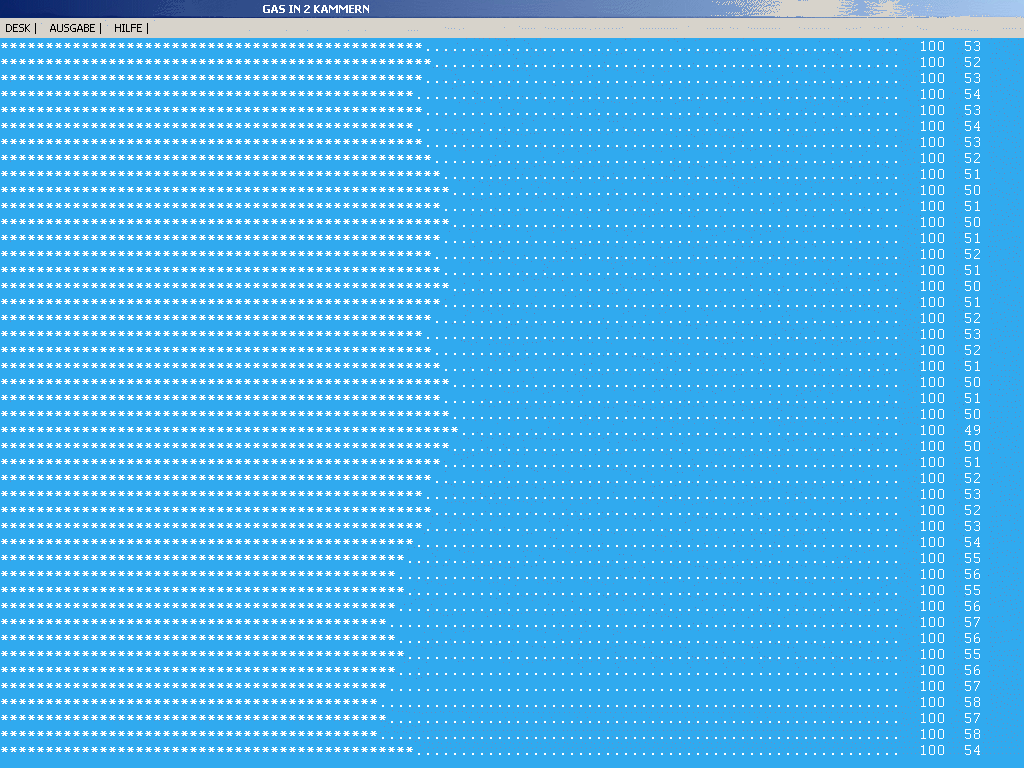 |
| Abb. 3: Diffusion eines Gases aus einem Raum A in
einen Raum B. "*" kennzeichnet ein Teilchen in Raum A, ". " in
Raum B (Darstellungsmodus b). Insgesamt werden hier 100
Teilchen eingesetzt, die Teilchenzahl in Raum A schwankt hier um
50. Die starken Fluktuationen mit Platzwechsel von jeweils einem
Teilchen sind erkennbar. |
Um N Teilchen aus Nmax Teilchen für den Bereich A
auszuwählen, gibt es g(Nmax, N) Möglichkeiten, wobei
g(Nmax,N) = Nmax!
/ (Nmax - N)!·N! mit N! = 1, 2, 3, .... N
("N Fakultät")
Durch N! wird dividiert, weil es auf die N! Vertauschungen innerhalb der
Teilchen von A nicht ankommt, ganz entsprechend durch (Nmax -
N)! .
Zu einem durch das Wertepaar (Nmax,N)
charakterisierten Makrozustand gibt es g(Nmax,N) mögliche
Mikrozustände.
Als Entropie des Systems A wird definiert:
| S = kB · log [ g(Nmax,N) ]
|
(Vgl. Hinweis). Für festes Nmax genügt
sie einer Glockenkurve in Abhängigkeit von N. S, für die jeweilige
Atomzahl N berechnet, ist in der oberen Zeile weiß dargestellt. Offenbar
hat S ein Maximum für N = Nmax / 2 .
In der unteren Zeile wird die durch häufige Wiederholung der Übertritte
entstehende Häufigkeitsverteilung dargestellt, nämlich kB · log
( h( Nmax,N) ). Nach sehr großer Anzahl von Versuchen
geht die Häufigkeitsverteilung in die Wahrscheinlichkeitsverteilung über
(schwarz). Es stellt sich heraus, dass das Entropiemaximum mit der häufigsten
Verteilung übereinstimmt.
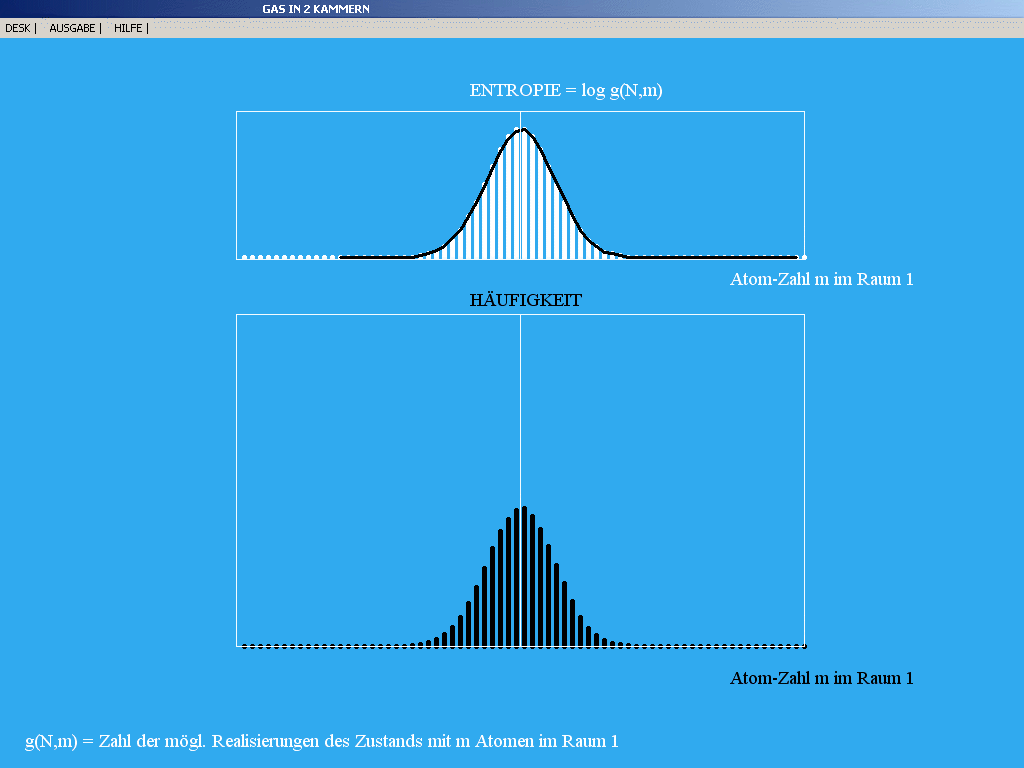 |
| Abb. 4: Vergleich von Häufigkeitsverteilung mit
Wahrscheinlichkeitsverteilung (Entropie) bei sehr großer Zahl
von Versuchen. In beiden Fällen ist der natürliche Logarithmus
dargestellt. Das Maximum ist umso schärfer, je größer Nmax.
Im Programm heißt Nmax: N und N: m. |
Ergebnisse:
1. Es finden starke Fluktuationen der Teilchenzahlen N (bzw. m)
statt.
2. Das Maximum der Entropie kennzeichnet die wahrscheinlichste
Verteilung, die durch viele Versuche auch als häufigste Verteilung
ermittelt wird.
3. Thermisches Gleichgewicht ist durch das Maximum der Entropie
gekennzeichnet.
4. Die Entropie ist ein Maß für die Wahrscheinlichkeit einer bestimmten
Verteilung mit N (bzw. m) Teilchen aus Nmax (bzw.
N) Teilchen.
| Beachten Sie wieder:
All dies ist nur eine Folge der Statistik, also des
geschickten Zählens bzw. des "Gesetzes der großen Zahlen",
nicht von irgendwelchen "Mechanismen", die ein bestimmtes
Verhalten der Teilchen "bewirken" würden. Der
Gleichgewichtszustand ist der Zustand, zu dem die meisten Wege
führen, der sich auf maximale Anzahl von Weisen realisieren
lässt.
Über die Teilchen selbst wurden fast keine Annahmen
gemacht, außer dass für sie Ortswechsel möglich sind, und dass
sie in einen Zustand mit der Energie E angeregt werden können.
|
Hinweis:
Es gibt mehrere gleichwertige Definitionen der Entropie. Statt g(Nmax,N)
kann zum Beispiel die Wahrscheinlichkeit p(Nmax,N) für die
entsprechende Verteilung verwendet werden. Alle Definitionen unterscheiden
sich höchstens um einen belanglosen additiven Anteil, der für N => ∞¥
klein ist im Vergleich zu anderen Termen.
Anhang:
1. Nachweis, dass für große Teilchenzahlen die Formeln für T, S
und 1/T = (∂S/∂U)N = konst miteinander konsistent
sind , also die statische und die thermodynamische Definition
Aus S = kB·log g(Nmax,N) soll mittels 1/T = (∂S/∂U)N =
konst hergeleitet werden: T = E/kB
1/ log [ ( Nmax - N )/N ] , wobei
g(Nmax,N) = Nmax! / (Nmax - N)!
N!
(N aus Nmax )
Zunächst: S = kB [ log Nmax!
- log (Nmax - N)! - log N! ]
Wegen der für große N gültigen Näherungsformel nach Stirling
log N! »
N·log N - N gilt dann:
S = kB [ Nmax log Nmax
- (Nmax - N) log (Nmax - N) - N log N
- Nmax + (Nmax - N) + N ]
und damit
S = kB [ Nmax log Nmax
- (Nmax - N) log (Nmax - N) - N log N
]
S = - kB [ ( (Nmax - N)
log ( (Nmax - N) / Nmax ) +
N log N/Nmax ]
S = - kB [ Nmax (
(1 - N/Nmax) log ( (1- N/Nmax )
+ N/Nmax log N/Nmax
]
S ist damit proportional zu Nmax (extensive Größe ! )
und hängt sonst nur mehr von den Teilchenzahl-Verhältnissen x = N/Nmax
ab, also:
S = - kB Nmax [ ( (1
- x) log ( (1- x ) + x log x ]
Wenn jetzt definiert wird: 1/T = (∂S/∂U)Nmax
= konst bzw. wegen U = N·E
1/T = 1/E (∂S/∂N)Nmax = konst = 1/E
(∂S/∂x)Nmax = konst 1/Nmax , dann
folgt:
1/T = - 1/E kB [ -(1- x) 1/(1-x) - log (1-x) + x 1/x + log x
] = - 1/E kB [ - log (1-x) + log x ] = 1/E kB
[ log (1-x)/x ) bzw. eben
| 1/T = kB/E log [ ( Nmax -
N )/N ] |
Man sieht, T ist im Unterschied zu S eine intensive Größe,
die nur vom Teilchenzahl-Verhältnis x abhängt. Dieser Ausdruck wird für
die Simulation des Programms ENTROPIE auch bei kleineren
Teilchenzahlen als Näherungswert für T benutzt.
2. Nachweis, dass sich eine Nullpunktsverschiebung,
z.B. im Zusammenhang mit der Grundzustandsenergie, nicht auswirkt. Diese
sei jetzt E0 =/= 0. Dann gilt z.B. für die mittlere
(Anregungs-)Energie
<E> = ∑i p(Ei )·Ei
mit p(Ei) = exp ( - (E0 + Ei ) / kBT
) / Z und
Z = ∑i exp ( - (E0
+ Ei ) / kBT ) .
In Zähler und Nenner lässt sich der Faktor exp ( - E0/ kBT
) ausklammern und wegkürzen. Sie erhalten wieder das frühere Ergebnis mit
den (Anregungs-)Energien Ei. Analog für unser Modellsystem mit
der (Anregungs-)Energie E:
N / Nmax = exp ( + E0/ kBT ) / ( exp (
+ E0 / kBT ) + exp ( + (E0 + E ) / kBT
) )
= exp ( - E) / kBT ) / ( 1 + exp ( - E / kBT ) )
wie oben.
Rückwärts folgt nach Auflösung nach T die gleiche Definitionsgleichung
für T wie oben.
Zusammenfassung:
Für ein einfaches Modellsystem wurde die Definition der Begriffe
Temperatur und Entropie theoretisch und experimentell mittels Simulationen
untersucht. Daraus ergibt sich der vereinfachende Vorschlag, für die
Schule die Temperatur in zwei Schritten zu definieren:
1. Die Temperatur T ist ein objektives Maß für den Wärmezustand
eines Systems (im thermischen Gleichgewicht).
Der Wärmezustand kann an der Schule nicht exakt definiert werden, doch
sollten einige wesentliche Aspekte, die im Text erläutert sind, zur
Sprache kommen.
2. Die Temperatur T ist ein Parameter, der bestimmt, wie die
Energien von Teilchen im thermischen Gleichgewicht verteilt sind. Je
höher die Temperatur T, desto mehr Teilchen werden in höhere Energien
angeregt, oder in desto höhere Energien werden Teilchen angeregt.
Das ist auch kompatibel mit üblichen Aussagen zum idealen Gas - die
Anregungsenergie ist hier kinetische Energie - , aber eben auch zu anderen
in der Schule behandelten Systemen, die keine kinetische Energie haben,
wie die Strahlung. Insbesondere ist das kompatibel zu der Aussage, dass
beim idealen Gas die mittlere kinetische Energie proportional zur
absoluten Temperatur ist.
Ein derartiges Konzept könnte falsche Argumente, wie sie in Schulbüchern
vielfach üblich sind, verhindern.
(zuletzt aktualisiert: Juli 2013)
(einige Formulierungen verschärft: Juni 2018)



