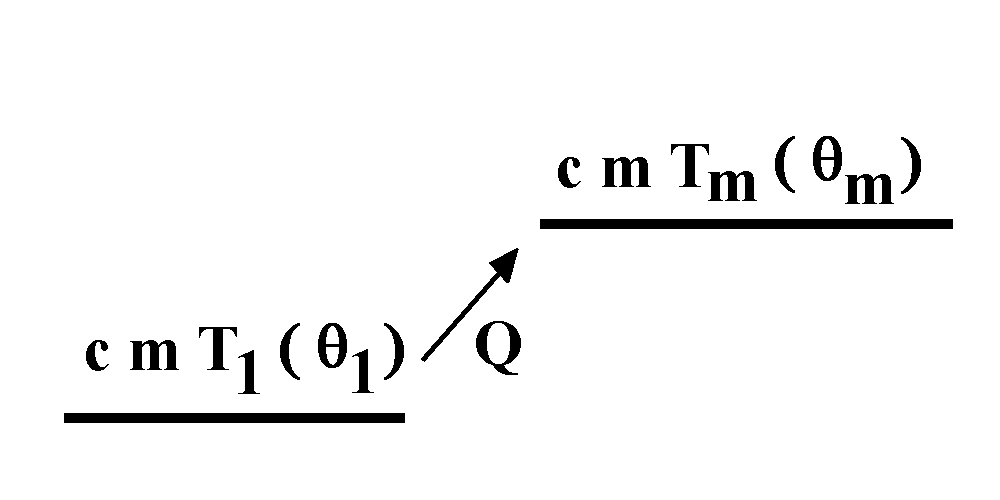
Das Bild sagt: Führt man die Wärme Q zu, dann wächst die Temperatur von T1 auf Tm bzw. von θ1 auf θm.
|
SG031
Spezifische Wärmekapazität c ©
H. Hübel Würzburg 2013
|
Impres-sum |
Führt man einem Körper der Temperatur T1 eine Wärme Q zu, dann erhöht sich in der Regel seine innere Energie um ΔEinn und auch seine Temperatur T bis zu einer "Mischungstemperatur" Tm. Versuche zeigen:
| Q = ΔEinn = c·m·ΔT = c·m·(Tm - T1) |
c ist die spezifische Wärmekapazität, m die Masse des Körpers. c ist häufig temperaturunabhängig.
Man hätte dieses Gesetz auch mit der Celsius-Temperatur Θ formulieren können, da es nur auf die Temperaturdifferenz ankommt:
| Q = ΔEinn = c·m·ΔΘ = c·m·(Θm - Θ1) |
(jeweils höhere Temperatur - niedere Temperatur)
Um 1 kg Wasser von 100C auf 900C zu erwärmen, wird eine Wärmemenge Q = 335,2 kJ benötigt. Die spezifische Wärmekapazität c von Wasser beträgt also c = Q/(m·ΔΘ) = 335,2 kJ/(1 kg·80 K) = 4,19 kJ/(kg·K). Um 1 kg Wasser (also 1 l) um 1 K zu erwärmen, muss eine Energie von 4,19 kJ zugeführt werden.
c heißt Wärmekapazität, weil bei größerer Wärmekapazität mehr Wärme zu- oder abtransportiert werden muss, um die gleiche Temperaturänderung zu erzielen, ähnlich wie bei einem Eimer mit dem größeren "Fassungsvermögen" mehr Wasser zugeführt werden muss, um die gleiche Änderung des Füllstands zu erreichen. Sie heißt spezifisch, weil sie auf 1 kg Masse bezogen ist. c hängt vom Stoff ab. Nicht bei allen Stoffen ist c temperaturunabhängig.
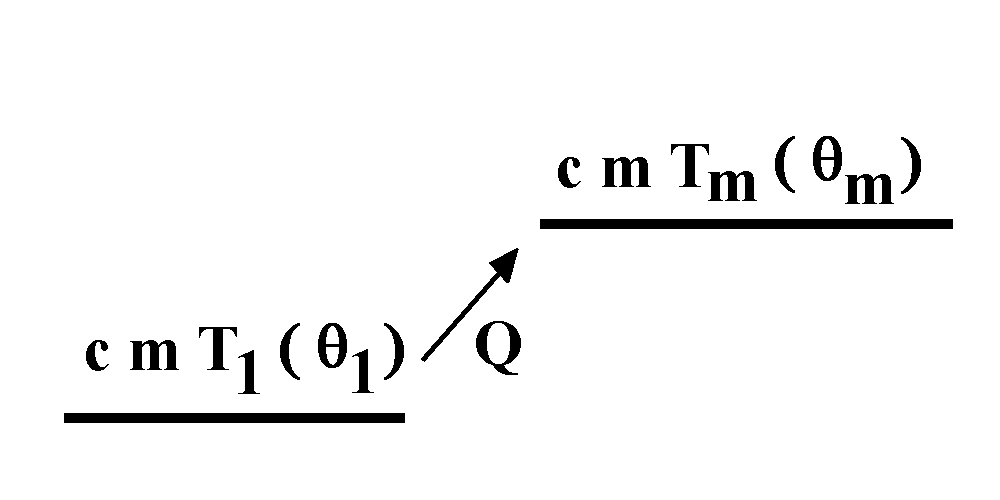 |
Die Temperaturverhältnisse werden manchmal durch
ein "Temperaturniveauschema" dargestellt: Je höher das
Temperaturniveau, desto höher die Temperatur, ganz gleich, ob
absolute oder Celsius-Temperatur.
Das Bild sagt: Führt man die Wärme Q zu, dann wächst die Temperatur von T1 auf Tm bzw. von θ1 auf θm. |
Bringt man einen Körper der Temperatur T1 in Kontakt mit einem Körper der höheren Temperatur T2, dann verliert der Körper mit der höheren Temperatur innere Energie. Er gibt also die Wärme Qab ab. Der kältere Körper nimmt im Idealfall diese Wärme (als Qauf) auf und erhöht damit seine innere Energie. In beiden Körpern bildet sich eine Mischungstemperatur Tm aus. Der kältere Körper erwärmt sich bis zur Mischungstemperatur, der wärmere Körper kühlt sich bis zur Mischungstemperatur Tm ab.
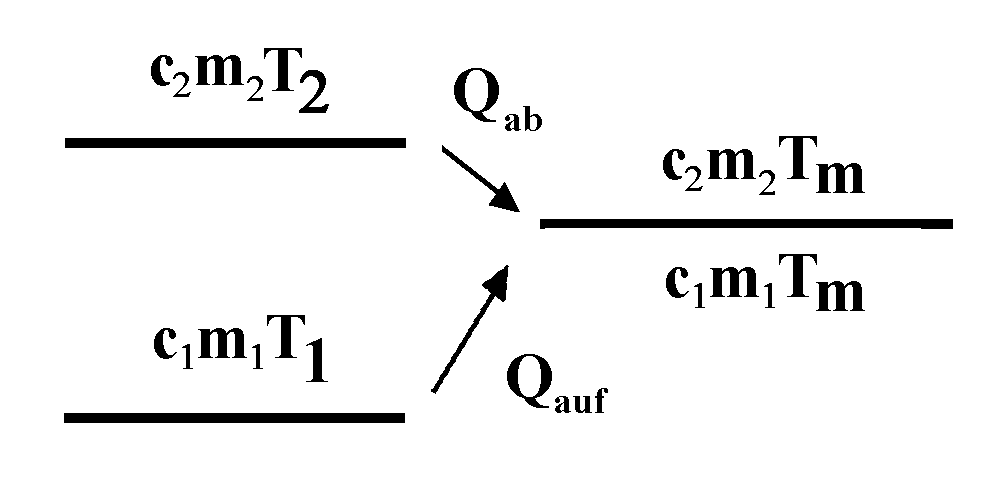 |
Die Temperaturverhältnisse werden wieder durch ein "Temperaturniveauschema" dargestellt: Je höher das Temperaturniveau, desto höher die Temperatur, ganz gleich, ob absolute oder Celsius-Temperatur. Die Mischungstemperatur Tm liegt zwischen T1 und T2. Du hättest auch wieder die Celsiustemperatur verwenden können. |
Wenn keine Energieverluste auftreten, wenn also keine Energie nach außen abgegeben wird, gilt
| Qab = Qauf |
Wenn du die positiven Temperaturdifferenzen aus dem Temperaturniveauschema abliest, erhältst du also mit
Qauf = c1·m1·ΔT1= c1·m1·(Tm - T1)
Qab = c2·m2·ΔT2 = c2·m2·(T2 - Tm)
c1·m1·(Tm - T1) = c2·m2·(T2 - Tm) oder ganz entsprechend mit den Celsius-Temperaturen Θ1 und Θ2 .
(Wundere dich nicht, dass hier Tm an unterschiedlichen Stellen steht. Die Regel ist immer: Größere Temperatur - kleinere Temperatur. Hier hilft dir das Temperaturniveauschema.)
Die Gleichung ist nützlich zur Bestimmung der
Mischungstemperatur Tm oder einer spezifischen Wärmekapazität
c, wenn die andere bekannt ist, mit Hilfe von Mischungsversuchen. Aus
der spezifischen Wärmekapazität kann man viel lernen über den atomaren
Aufbau des Stoffes. Natürlich kann man auch nach der Masse m1
eines Körpers fragen, den man zumischen muss, um eine bestimmte
Mischungstemperatur zu erreichen.
Bemerkenswert ist die hohe spezifische Wärmekapazität von Wasser. Ihr haben wir ausgeglichene Temperaturen auf der Erde zu verdanken. Auf dem (wohl weitgehend) wasserlosen Mars schwanken die Temperaturen im Lauf eines Tages um bis zu 100 K.
.
( September 2013 )