 |
|
SG133 Gestalt und Größe von Atomen ©
H. Hübel Würzburg 2013
|
Impres-sum |
Atome sind so klein, dass sie niemand sehen kann, auch nicht mit den stärksten optischen Mikroskopen. Um sich über ihre Größe und Gestalt klar zu werden und sich ein "Bild vom Atom zu machen", muss man indirekte Methoden anwenden. Diese "Bilder von Atomen" heißen auch Modelle.
Solche wissenschaftlich gesicherten Methoden wurden erst in den letzten 100 Jahren entwickelt. Aber bereits zuvor hat man sich Modelle von Atomen gemacht, die bestimmte Beobachtungen erklären konnten bzw. plausibel machen konnten. Modelle werden so gut wie möglich konstruiert, aber entsprechen nur teilweise der Realität.
Das einfachste Modell von Atomen ist das der harten Kugeln.
Danach soll ein Atom einem Tischtennisball oder einer Kugellagerkugel mit einem festen Radius ähneln. Verschiedene Beobachtungen führten zur Annahme von einem Kugelradius von ca. 10-10 m im niedrigsten Energiezustand.
| Typischer Atomradius: 10-10 m |
Wenn es gelänge, ca. 5 Milliarden solcher Atome lückenlos aneinander zu reihen, würden diese eine Kette von 1 m Länge bilden. Oder anders: Würde man jedes dieser Atome auf 4 cm Radius vergrößern, also etwa auf die Größe einer Orange, würde die Kette von der Erde bis über den Mond hinaus reichen. Die Atomradien variieren stark von Element zu Element und können bei sehr hoch angeregten Atomen (Rydberg-Atome) bis zu 10 000 mal größer als beim Wasserstoff-Atom im niedrigsten Energiezustand sein.
Das einfachste und leichteste Atom ist ein Wasserstoff-Atom (H-Atom). Bohr fand feste Energiestufen im Atom, indem er die Wellenlängen von Spektrallinien deutete. Bohr's Modell des H-Atoms kommt der Realität insofern schon recht nahe, als es die Farbe (die Wellenlänge λ bzw. die Frequenz f = c/λ) des abgestrahlten Lichts durch bestimmte, feste Energiestufen schon recht genau erklärt. Beim Übergang von einem höheren zu einem tieferen Energieniveau verliert das Atom Energie, die in Form eines Photons mit der Differenzenergie (ΔE = h·f = h·c/λ) und damit bestimmter Frequenz und Wellenlänge abgestrahlt wird. Früher hatte man daraus auch auf den Aufbau aus einem positiven Atomkern und einem negativen Elektron geschlossen, das den Kern auf einer Bahn mit einem festen Radius umkreisen sollte, wie die Erde die Sonne umkreist (Planetenmodell: qualitativ geht es auf Rutherford zurück). Abbildungen der räumlichen Gestalt dieses Bohr'schen Atommodells (oder ähnlicher Modelle für Vielektronen-Atome), die du sicher schon gesehen hast, sind eindrucksvoll. Du solltest sie aber nicht allzu ernst nehmen; sie sind irreführend, weil z.B. Elektronen nicht auf festen Bahnen den Atomkern umkreisen, oder weil ein Elektron ohne eine Messung keinen Ort hat (oder weil die Z (Stück) Elektronen in einem Vielelektronen-Atom gar keine individuellen Elektronen mit festen Eigenschaften sind: sie bilden einen verschränkten Zustand). Immerhin es ergibt sich so für Abschätzungen etwas wie ein Maß für einen Atomradius: 0,5·10-10 m im tiefsten Energiezustand. Ein solches Atom ist also das kleinste Atom aus normaler Materie.
Schwerere Atome enthalten mehr Elektronen. Ihre Zahl entspricht der Kernladungs- oder Ordnungszahl Z. Aber die Annahme, dass sie den Atomkern wie kleine Kügelchen umkreisen, führte zu Bildern des Atoms, die noch weitaus problematischer als das Bohr'sche Modell des H-Atoms sind. Vielleicht hast du schon einmal eine Abbildung von einem solchen Planeten-Modell eines Uran-Atoms gesehen. Das Modell ist faszinierend komplex aufgebaut und sehr ästhetisch, entspricht aber leider nicht der Realität. Es soll hier lieber nicht abgebildet werden. Und ein entsprechendes Bohr'sches Modell dafür ließ sich auch nicht finden.
Das heute anerkannte quantenmechanische Atommodell lässt sich nur schwer abbilden. Von einem H-Atom findet man nämlich das einzige Elektron bei aufeinander folgenden Messungen immer wieder an einem anderen Ort, ganz selten auch auf dem Mond (wenigstens im Prinzip), selten auch nahe des Atomkerns, am häufigsten aber in der Nähe einer der Radien, die Bohr für sein Atommodell berechnet hatte. Man kann tatsächlich nur eine Wahrscheinlichkeit dafür angeben, das Elektron in der Nähe einer bestimmten Stelle um den Atomkerns zu finden. Deshalb ist es schwer zu sagen, "wo ein Atom aufhört". Manchmal spricht man auch von einem Wolkenmodell, weil die vielen Punkte, an denen man Messungen vornehmen müsste, um die Gestalt des Atoms zu erfassen, eine Punktewolke bilden. Die Punktewolke müsste eigentlich bis ins Unendliche reichen. Deshalb wird ein Atomradius häufig als Radius einer Kugel definiert, innerhalb der in 90% aller Fälle das Elektron zu finden ist. Dann ergibt sich wieder ein Radius in der Größenordnung von 10-10 m.
|
 |
|
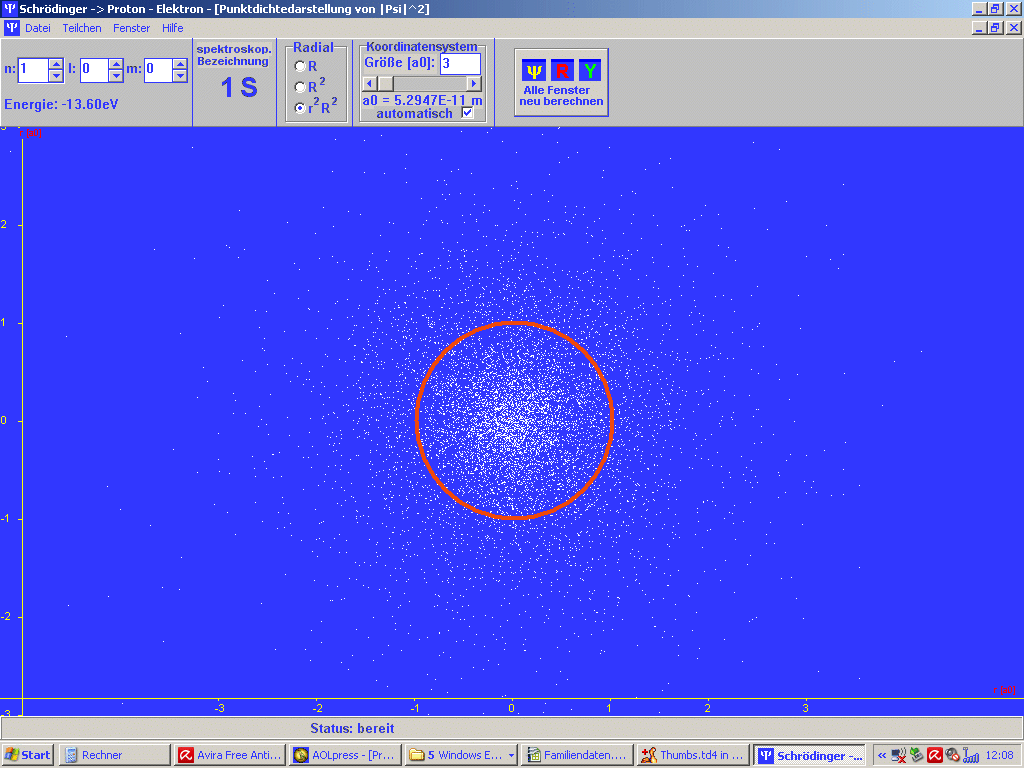
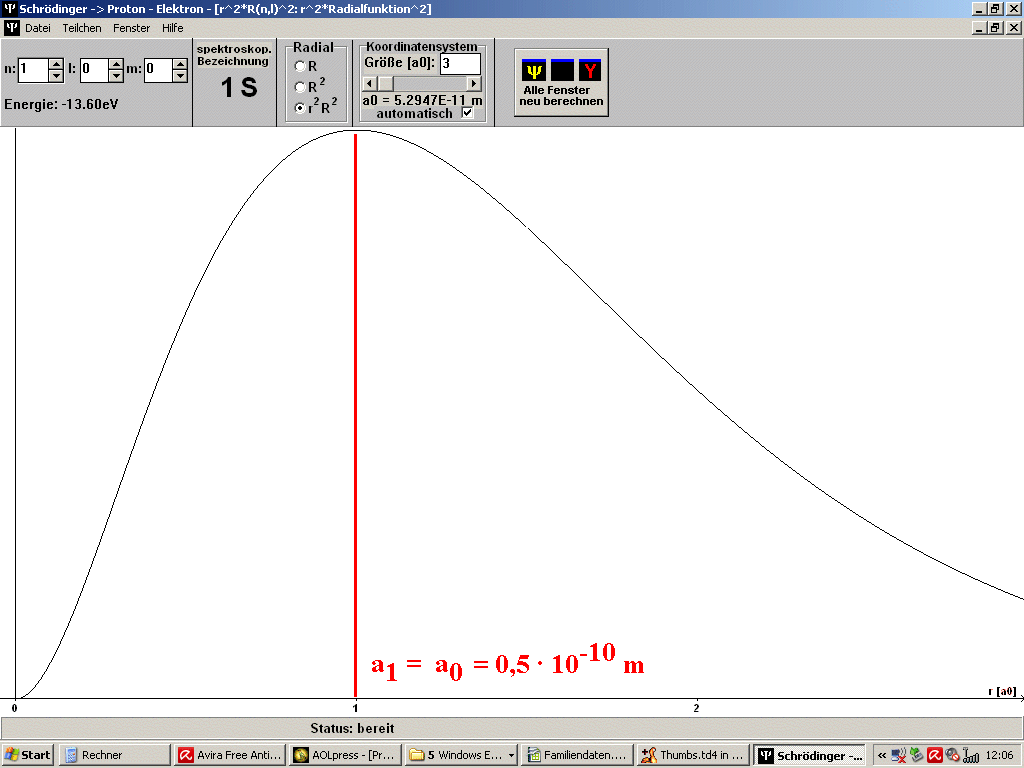
| Abb. 1: Mit dem Programm SCHRÖDINGER der Universität Würzburg (Steinrück, Girwidz, Götz) berechnete Punktwolke für das H-Atom im Grundzustand (1S). Es handelt sich in der Darstellung um einen ebenen Schnitt durch den Atomkern. Es ist auch noch der Bohr'sche Wasserstoff-Radius a1 = a0 eingezeichnet. Du musst dir das 3-dimensional vorstellen. Die rote Linie ist dann eine Kugel um den Atomkern. | Abb. 2: Dass beim Bohr'schen Wasserstoff-Radius ein Maximum der radialen Wahrscheinlichkeitsverteilung vorliegt, erkennt man besser an diesem Bild, erzeugt mit dem gleichen Programm. Das gilt aber nur für solche Zustände, bei denen die Bahndrehimpulsquantenzahl l = n - 1 ist mit der Hauptquantenzahl n. Das Bild passt also z.B. zum Grundzustand des H-Atoms mit n =1, l = 0. |
Auch das Wolkenmodell beschreibt das Atom nur unzureichend, insbesondere bei Atomen mit mehr als einem Elektron (Kernladungszahl Z > 1). Das Elektronium-Modell ist ein ähnliches didaktisches Modell. Es versucht der Tatsache gerecht zu werden, dass man in der Atomhülle zwar Z Elektronen findet, dass diese aber ohne eine Messung keine individuellen Eigenschaften haben. Man sollte sich aber nicht vorstellen, dass das Atom von einer materiellen Substanz mit dem Namen Elektronium umgeben sei.
Mathematisch lässt sich das Atom jedoch mit der Quantentheorie sehr genau beschreiben.
Wenn man mit den erwähnten indirekten Methoden die Gestalt eines Atoms bzw. vieler Atome (auf einer Kristalloberfläche etwa) erfassen möchte, geht man häufig vom Modell einer harten Kugel aus, deren Lage und Radius so angepasst wird, dass die Messergebnisse möglichst genau reproduziert werden. Das ist z.B. bei einem Rastertunnelmikroskop so. So entstehen sogar Bilder einzelner Atome auf einer Kristalloberfläche.
In bestimmten Zuständen kann ein Atom auch eine nicht kugelige Form annehmen. Das fällt besonders auf, wenn eine Richtung ausgezeichnet ist, z.B. durch ein Magnetfeld oder durch die Struktur des Kristalls, in den das Atom eingebaut ist. Für Bindungen in einem Molekül, einem Kristall oder für Ferromagneten sind solche Abweichungen besonders wichtig. Bei freien Atomen ist keine solche Richtung ausgezeichnet, deswegen sind dort Zustände mit unterschiedlicher Orientierung (und sonst gleichen Eigenschaften) überlagert, so dass sich statistisch doch wieder eine kugelige Gestalt ergibt.
Heutzutage kann man mit einem einzelnen Atom experimentieren. Man kann es
z.B. in eine "Falle" einsperren und ihm dort mit einem Laser Energie
zuführen, die es dann in Form eines kleinen Lichtblitzes wieder abgibt.
Bei geeigneter Lichtwellenlänge (bei einem Ba-Atom) kann man den
Lichtblitz sogar mit freiem Auge sehen.
.
( Mai 2014 )